推荐产品
公司新闻/正文
分子探针与表观遗传学研究好文分享:CTBP2-PCIF1复合物调控头颈部鳞状细胞癌中mRNA的m6 Am修饰(IF=15.9004)
人阅读 发布时间:2023-11-13 13:26
The CTBP2-PCIF1 complex regulates m6 Am modification of mRNA in head and neck squamous cell carcinoma《Journal of Clinical Investigation》(IF=15.9004)
摘要:
PCIF1可介导mRNA中N6,2‘-o-二甲基腺苷(m6 Am)的甲基化。然而,PCIF1与潜在的辅助因子之间的详细相互作用及其病理意义尚不明确。
在这里,我们证明了pcif1介导的帽mRNA m6 Am修饰在体外和体内均促进了头颈部鳞状细胞癌的进展。CTBP2被鉴定为PCIF1的辅助因子,可催化m6 Am在mRNA上的沉积。
CLIP-Seq数据显示,与PCIF1相比,CTBP2结合的mRNA 相似。然后,我们使用m6 Am-Seq方法在单碱基分辨率下分析m6 Am位点,发现众所周知的肿瘤抑制因子TET2的mRNA是PCIF1-CTBP2复合物的主要靶底物。在机制上,敲除CTBP2降低了PCIF1在TET2 mRNA上的占用,而PCIF1-CTBP2复合物负调控TET2 mRNA的翻译。
总的来说,我们的研究证明了表观转录组调控因子PCIF1-CTBP2复合物的致癌功能,强调了m6 Am修饰在肿瘤进展中的重要性。
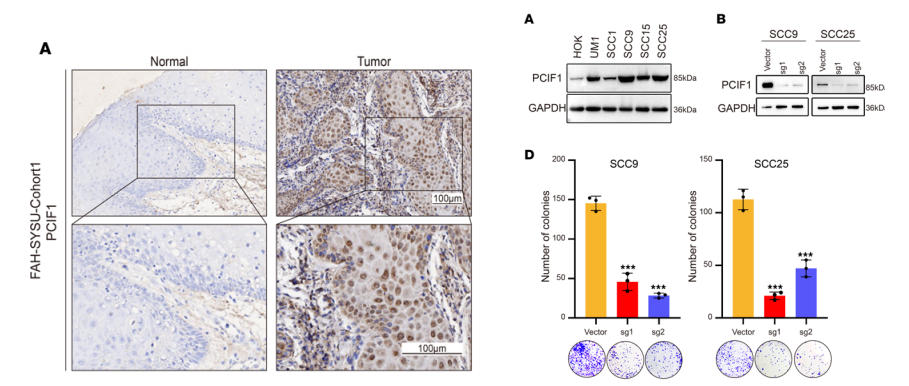 PCIF1的表达及其与HNSCC临床病理参数的相关性。我们发现,在HNSCC患者中,PCIF1的mRNA的表达明显高于非癌症受试者。
PCIF1的表达及其与HNSCC临床病理参数的相关性。我们发现,在HNSCC患者中,PCIF1的mRNA的表达明显高于非癌症受试者。
采用PCIF1免疫组化染色,结果显示,PCIF1主要表达局限于肿瘤细胞的细胞核,且PCIF1在HNSCC组织中的表达明显高于正常组织。
为了探讨PCIF1在HNSCC中的作用,我们采用蛋白印迹法检测PCIF1在HNSCC细胞系和正常人口腔角质形成细胞(HOKs)中的表达。与HOKs相比,所有5个HNSCC细胞系的PCIF1表达水平均最高;SCC9和SCC25的PCIF1表达水平最高。转染CRISPR/Cas9后,两种细胞系中PCIF1蛋白水平均显著下降。
另外,我们在SCC1细胞中过表达PCIF1,与其他HNSCC细胞系相比,该细胞中PCIF1的表达水平最低。这些数据表明,PCIF1促进了HNSCC细胞的致瘤特性,这依赖于其完整的活性。

为了探索PCIF1的多功能性并识别未知的蛋白结合伙伴,使用PCIF1抗体下拉样本和IgG对照样本进行MS-iTRAQ分析。在所有候选蛋白中,CTBP2在两个样本中的富集量都最高,这表明PCIF1和CTBP2蛋白之间可能存在相互作用。
我们进行了免疫沉淀-Western印迹,发现SCC25细胞中内源性PCIF1和CTBP2蛋白之间存在正相互作用。此外,GST下拉实验,重组PCIF1(FLAG-PCIF1)和CTBP2(GST-CTBP2)蛋白显示了PCIF1和CTBP2之间的直接相互作用。PCIF1是一种众所周知的m6Am的帽特异性n6-甲基转移酶。
为了确定PCIF1和CTBP2是否影响mRNA m6Am的修饰,我们使用液相色谱-串联质谱法测定了封壳后多聚(A)富集RNA中m6Am的水平。
我们发现PCIF1或CTBP2的KO降低了SCC25细胞中的m6Am水平,但没有降低m6A水平,这表明CTBP2参与了PCIF1介导的m6Am修饰。随后,我们使用细胞模型对PCIF1和CTBP2进行了功能验证,结果表明,CTBP2可能作为PCIF1的关键辅助因子,在HNSCC中发挥关键的分子功能作用。
为了进一步研究PCIF1和CTBP2之间的潜在相互作用,我们使用交联和免疫共沉淀,然后进行高通量测序(CLIP-Seq)来评估这些蛋白结合的mRNA的相似性。通过分析CLIP-Seq数据集,我们观察到PCIF1和CTBP2结合的mRNA之间有高度的重叠(补充图5A)。
我们的分析显示了PCIF1-和ctbp2结合mRNA的类似富集模式。在“细胞迁移”和“转录正向调控”通路中均表现出富集。证实了PCIF1和CTBP2之间潜在的调控相互作用。
为了鉴定被PCIF1和CTBP2修饰的潜在靶标转录本,我们使用PCIF1-KO和CTBP2-KO SCC25细胞来检测m6Am-Seq,我们发现382m6am修饰的基因在所有样本中都是共享的,突出了PCIF1和CTBP2修饰的转录本的共性。
对测序聚类的分析发现,在PCIF1和CTBP2的m6Am位点内存在一致的“CA”基序。PCIF1调控的基因在多个生物过程中大量富集,包括转录调控、IκB激酶/NF-κB信号通路的调控、中心体周期和组蛋白H3乙酰化途径。此外,我们还发现部分生物过程受到PCIF1和CTBP2的共同调控,如转录调控。
我们使用Ribo-Seq分析了核糖体保护的mRNA片段,从而在对照细胞和PCIF1-KO SCC25细胞中生成全基因组翻译景观。GO分析显示,大多数富集的类别与转录和RNA甲基化调控相关。我们发现TET2是一种肿瘤抑制基因,它催化5-甲基胞嘧啶(5mC)转化为5-羟甲基胞嘧啶(5hmC)并促进DNA去甲基化。
在PCIF1 KO和CTBP2 KO中,TET2转录本的5‘-utr中有2 m6Am位点,表明TET2可能是HNSCC中PCIF1和CTBP2的下游靶点。
 TET2的帽邻m6Am阻碍了TET2 mRNA的翻译。TET2表达的调节可能以m6am依赖的方式发生。为了验证这一点,我们采用荧光素酶报告基因,以了解这些m6Am修饰在基因调控中的功能。
TET2的帽邻m6Am阻碍了TET2 mRNA的翻译。TET2表达的调节可能以m6am依赖的方式发生。为了验证这一点,我们采用荧光素酶报告基因,以了解这些m6Am修饰在基因调控中的功能。
我们发现PCIF1的过表达损害了荧光素酶报告基因的翻译,而m6Am基序突变或突变PCIF1消除了PCIF1的翻译衰减,表明这些m6Am修饰对PCIF1介导的TET2表达至关重要。
我们想知道CTBP2是否会影响TET2 mRNA与PCIF1的相互作用。采用RNA免疫共沉淀检测TET2转录本中PCIF1或CTBP2与帽状相邻的m6Am之间的相互作用。
PCIF1显著富集了TET2 mRNA,而这在PCIF1-KO和CTBP2-KO细胞中,相对富显著被抑制。PCIF1的缺失对CTBP2与TET2 mRNA的结合没有影响,这表明CTBP2是PCIF1与mRNA相互作用所必需的。
此外,我们使用WT CTBP2和一个具有PCIF1结合缺陷的CTBP2突变体进行了拯救实验。这进一步验证了PCIF1和CTBP2之间的相互作用,并强调了CTBP2在促进它们与TET2 mRNA结合方面的关键作用。
为了研究PCIF1对HNSCC的影响是否是由TET2激活介导的,我们通过转染靶向TET2的ssiRNA来敲除WT或PCIF1-KO SCC9和SCC25细胞系中TET2的表达,结果表明PCIF1 KO导致了SCC9和SCC25细胞中TET2表达水平的升高。
 我们想检验是否可以通过使用4nqo诱导的小鼠HNSCC模型在体内进行验证,该模型与人类的HNSCC非常相似。
我们想检验是否可以通过使用4nqo诱导的小鼠HNSCC模型在体内进行验证,该模型与人类的HNSCC非常相似。
我们发现,与对照组相比,Pcif1-cKO组的口腔肉眼可见的病变面积和数量不那么明显,而Tet2-cKO小鼠的口腔病变面积和数量呈中度增加。Tet2的基因消融能够增强HNSCC的形成。
与预期的一样,与对照组小鼠相比,从Pcif1-cKO小鼠衍生的肿瘤中增殖标志物Ki67的表达较低。Pcif1的消耗显著增加了全球5hmC水平,而Tet2的阻断产生的5hmC显著减少。我们还使用了TET酶抑制剂Bobcat339(BC339)来治疗携带HNSCC的小鼠。
我们发现BC339的处理逆转了PCIF1 KO对HNSCC形成和侵袭性的影响。此外,BC339的治疗也极大地挽救了Pcif1-cKO样本中细胞增殖和转移的减少。经过BC339处理后,5hmC水平有所恢复。
然后我们在体内测试Ctbp2在体内的功能。我们随后生成了一个条件敲除小鼠,该小鼠中Ctbp2基因的关键外显子两侧有loxP位点(Ctbp2fl)。
我们发现Ctbp2-cKO的舌组织中病变面积更小,病变面积更少。与对照组相比,Ctbp2-HNSCC的cKO HNSCC的肿瘤分级并不明显。突变体小鼠对HNSCC细胞的增殖和转移能力减弱。
这些结果表明,Ctbp2在化学诱导的HNSCC小鼠模型中是必不可少的。在Ctbp2-cKO小鼠中敲除Tet2可以在肿瘤进展方面弥补Ctbp2的损失。
我们还研究了Tet2在Ctbp2-cKO小鼠发育中的作用。与对照组小鼠相比,Ki67染色的肿瘤和PCK染色的颈部淋巴结显示出增强的增殖和转移能力。阻断Tet2显著减少5hmC的产生量,但Ctbp2的消耗显著增加了它的数量。
在本研究中,我们揭示了一种由PCIF1-CTBP2复合物介导的m6Am沉积在mRNA上的调控机制。结合体外和体内实验,我们证实了PCIF1- CTBP2催化TET2转录本上的cap m6Am修饰,并负调控其翻译。
这些发现突出PCIF1和m6Am在HNSCC进展中的功能作用,并为HNSCC治疗的新治疗策略的发展提供了证据。PCIF1和CTBP2在HNSCC患者中都是独立的预测因子,而在肿瘤病变中PCIF1和CTBP2核表达增加的患者往往预后不良。
PCIF1和CTBP2形成了一个蛋白复合物,这是催化帽m6Am修饰所必需的。阻断PCIF1-CTBP2复合物会损害肿瘤细胞的致瘤能力,部分原因是TET2肿瘤抑制因子的激活翻译。
我们的研究结果表明,PCIF1-CTBP2复合物可能是一个很有前途的抗癌治疗靶点。

作者使用伯信生物明星产品CLIP-Seq试剂盒进行了上述筛选与分子互作调控机制的研究。
摘要:
PCIF1可介导mRNA中N6,2‘-o-二甲基腺苷(m6 Am)的甲基化。然而,PCIF1与潜在的辅助因子之间的详细相互作用及其病理意义尚不明确。
在这里,我们证明了pcif1介导的帽mRNA m6 Am修饰在体外和体内均促进了头颈部鳞状细胞癌的进展。CTBP2被鉴定为PCIF1的辅助因子,可催化m6 Am在mRNA上的沉积。
CLIP-Seq数据显示,与PCIF1相比,CTBP2结合的mRNA 相似。然后,我们使用m6 Am-Seq方法在单碱基分辨率下分析m6 Am位点,发现众所周知的肿瘤抑制因子TET2的mRNA是PCIF1-CTBP2复合物的主要靶底物。在机制上,敲除CTBP2降低了PCIF1在TET2 mRNA上的占用,而PCIF1-CTBP2复合物负调控TET2 mRNA的翻译。
总的来说,我们的研究证明了表观转录组调控因子PCIF1-CTBP2复合物的致癌功能,强调了m6 Am修饰在肿瘤进展中的重要性。
 PCIF1的表达及其与HNSCC临床病理参数的相关性。我们发现,在HNSCC患者中,PCIF1的mRNA的表达明显高于非癌症受试者。
PCIF1的表达及其与HNSCC临床病理参数的相关性。我们发现,在HNSCC患者中,PCIF1的mRNA的表达明显高于非癌症受试者。
采用PCIF1免疫组化染色,结果显示,PCIF1主要表达局限于肿瘤细胞的细胞核,且PCIF1在HNSCC组织中的表达明显高于正常组织。
为了探讨PCIF1在HNSCC中的作用,我们采用蛋白印迹法检测PCIF1在HNSCC细胞系和正常人口腔角质形成细胞(HOKs)中的表达。与HOKs相比,所有5个HNSCC细胞系的PCIF1表达水平均最高;SCC9和SCC25的PCIF1表达水平最高。转染CRISPR/Cas9后,两种细胞系中PCIF1蛋白水平均显著下降。
另外,我们在SCC1细胞中过表达PCIF1,与其他HNSCC细胞系相比,该细胞中PCIF1的表达水平最低。这些数据表明,PCIF1促进了HNSCC细胞的致瘤特性,这依赖于其完整的活性。

为了探索PCIF1的多功能性并识别未知的蛋白结合伙伴,使用PCIF1抗体下拉样本和IgG对照样本进行MS-iTRAQ分析。在所有候选蛋白中,CTBP2在两个样本中的富集量都最高,这表明PCIF1和CTBP2蛋白之间可能存在相互作用。
我们进行了免疫沉淀-Western印迹,发现SCC25细胞中内源性PCIF1和CTBP2蛋白之间存在正相互作用。此外,GST下拉实验,重组PCIF1(FLAG-PCIF1)和CTBP2(GST-CTBP2)蛋白显示了PCIF1和CTBP2之间的直接相互作用。PCIF1是一种众所周知的m6Am的帽特异性n6-甲基转移酶。
为了确定PCIF1和CTBP2是否影响mRNA m6Am的修饰,我们使用液相色谱-串联质谱法测定了封壳后多聚(A)富集RNA中m6Am的水平。
我们发现PCIF1或CTBP2的KO降低了SCC25细胞中的m6Am水平,但没有降低m6A水平,这表明CTBP2参与了PCIF1介导的m6Am修饰。随后,我们使用细胞模型对PCIF1和CTBP2进行了功能验证,结果表明,CTBP2可能作为PCIF1的关键辅助因子,在HNSCC中发挥关键的分子功能作用。

为了进一步研究PCIF1和CTBP2之间的潜在相互作用,我们使用交联和免疫共沉淀,然后进行高通量测序(CLIP-Seq)来评估这些蛋白结合的mRNA的相似性。通过分析CLIP-Seq数据集,我们观察到PCIF1和CTBP2结合的mRNA之间有高度的重叠(补充图5A)。
我们的分析显示了PCIF1-和ctbp2结合mRNA的类似富集模式。在“细胞迁移”和“转录正向调控”通路中均表现出富集。证实了PCIF1和CTBP2之间潜在的调控相互作用。
为了鉴定被PCIF1和CTBP2修饰的潜在靶标转录本,我们使用PCIF1-KO和CTBP2-KO SCC25细胞来检测m6Am-Seq,我们发现382m6am修饰的基因在所有样本中都是共享的,突出了PCIF1和CTBP2修饰的转录本的共性。
对测序聚类的分析发现,在PCIF1和CTBP2的m6Am位点内存在一致的“CA”基序。PCIF1调控的基因在多个生物过程中大量富集,包括转录调控、IκB激酶/NF-κB信号通路的调控、中心体周期和组蛋白H3乙酰化途径。此外,我们还发现部分生物过程受到PCIF1和CTBP2的共同调控,如转录调控。
我们使用Ribo-Seq分析了核糖体保护的mRNA片段,从而在对照细胞和PCIF1-KO SCC25细胞中生成全基因组翻译景观。GO分析显示,大多数富集的类别与转录和RNA甲基化调控相关。我们发现TET2是一种肿瘤抑制基因,它催化5-甲基胞嘧啶(5mC)转化为5-羟甲基胞嘧啶(5hmC)并促进DNA去甲基化。
在PCIF1 KO和CTBP2 KO中,TET2转录本的5‘-utr中有2 m6Am位点,表明TET2可能是HNSCC中PCIF1和CTBP2的下游靶点。
 TET2的帽邻m6Am阻碍了TET2 mRNA的翻译。TET2表达的调节可能以m6am依赖的方式发生。为了验证这一点,我们采用荧光素酶报告基因,以了解这些m6Am修饰在基因调控中的功能。
TET2的帽邻m6Am阻碍了TET2 mRNA的翻译。TET2表达的调节可能以m6am依赖的方式发生。为了验证这一点,我们采用荧光素酶报告基因,以了解这些m6Am修饰在基因调控中的功能。
我们发现PCIF1的过表达损害了荧光素酶报告基因的翻译,而m6Am基序突变或突变PCIF1消除了PCIF1的翻译衰减,表明这些m6Am修饰对PCIF1介导的TET2表达至关重要。
我们想知道CTBP2是否会影响TET2 mRNA与PCIF1的相互作用。采用RNA免疫共沉淀检测TET2转录本中PCIF1或CTBP2与帽状相邻的m6Am之间的相互作用。
PCIF1显著富集了TET2 mRNA,而这在PCIF1-KO和CTBP2-KO细胞中,相对富显著被抑制。PCIF1的缺失对CTBP2与TET2 mRNA的结合没有影响,这表明CTBP2是PCIF1与mRNA相互作用所必需的。
此外,我们使用WT CTBP2和一个具有PCIF1结合缺陷的CTBP2突变体进行了拯救实验。这进一步验证了PCIF1和CTBP2之间的相互作用,并强调了CTBP2在促进它们与TET2 mRNA结合方面的关键作用。
为了研究PCIF1对HNSCC的影响是否是由TET2激活介导的,我们通过转染靶向TET2的ssiRNA来敲除WT或PCIF1-KO SCC9和SCC25细胞系中TET2的表达,结果表明PCIF1 KO导致了SCC9和SCC25细胞中TET2表达水平的升高。
 我们想检验是否可以通过使用4nqo诱导的小鼠HNSCC模型在体内进行验证,该模型与人类的HNSCC非常相似。
我们想检验是否可以通过使用4nqo诱导的小鼠HNSCC模型在体内进行验证,该模型与人类的HNSCC非常相似。
我们发现,与对照组相比,Pcif1-cKO组的口腔肉眼可见的病变面积和数量不那么明显,而Tet2-cKO小鼠的口腔病变面积和数量呈中度增加。Tet2的基因消融能够增强HNSCC的形成。
与预期的一样,与对照组小鼠相比,从Pcif1-cKO小鼠衍生的肿瘤中增殖标志物Ki67的表达较低。Pcif1的消耗显著增加了全球5hmC水平,而Tet2的阻断产生的5hmC显著减少。我们还使用了TET酶抑制剂Bobcat339(BC339)来治疗携带HNSCC的小鼠。
我们发现BC339的处理逆转了PCIF1 KO对HNSCC形成和侵袭性的影响。此外,BC339的治疗也极大地挽救了Pcif1-cKO样本中细胞增殖和转移的减少。经过BC339处理后,5hmC水平有所恢复。
然后我们在体内测试Ctbp2在体内的功能。我们随后生成了一个条件敲除小鼠,该小鼠中Ctbp2基因的关键外显子两侧有loxP位点(Ctbp2fl)。
我们发现Ctbp2-cKO的舌组织中病变面积更小,病变面积更少。与对照组相比,Ctbp2-HNSCC的cKO HNSCC的肿瘤分级并不明显。突变体小鼠对HNSCC细胞的增殖和转移能力减弱。
这些结果表明,Ctbp2在化学诱导的HNSCC小鼠模型中是必不可少的。在Ctbp2-cKO小鼠中敲除Tet2可以在肿瘤进展方面弥补Ctbp2的损失。
我们还研究了Tet2在Ctbp2-cKO小鼠发育中的作用。与对照组小鼠相比,Ki67染色的肿瘤和PCK染色的颈部淋巴结显示出增强的增殖和转移能力。阻断Tet2显著减少5hmC的产生量,但Ctbp2的消耗显著增加了它的数量。
在本研究中,我们揭示了一种由PCIF1-CTBP2复合物介导的m6Am沉积在mRNA上的调控机制。结合体外和体内实验,我们证实了PCIF1- CTBP2催化TET2转录本上的cap m6Am修饰,并负调控其翻译。
这些发现突出PCIF1和m6Am在HNSCC进展中的功能作用,并为HNSCC治疗的新治疗策略的发展提供了证据。PCIF1和CTBP2在HNSCC患者中都是独立的预测因子,而在肿瘤病变中PCIF1和CTBP2核表达增加的患者往往预后不良。
PCIF1和CTBP2形成了一个蛋白复合物,这是催化帽m6Am修饰所必需的。阻断PCIF1-CTBP2复合物会损害肿瘤细胞的致瘤能力,部分原因是TET2肿瘤抑制因子的激活翻译。
我们的研究结果表明,PCIF1-CTBP2复合物可能是一个很有前途的抗癌治疗靶点。

作者使用伯信生物明星产品CLIP-Seq试剂盒进行了上述筛选与分子互作调控机制的研究。